EL NÚMERO DE AVOGADRO y EL MOL
El químico italiano Amadeo Avogadro, fue el primero en establer un número constante y adecuado que nos permitiera trabajar con cantidades no tan ingentes. Estableció el mol y su relación con los átomos y las moléculas. Al igual que manejamos la docena para el día a día, el químico usa el mol para que sus cálculos y previsiones sean más adecuados. Así, la unidad empleada por los químicos para expresar el peso de los átomos es el equivalente a un número muy grande de partículas y recibe el nombre de mol. De acuerdo con el Sistema Internacional, el mol se define como la cantidad de sustancia que contiene tantas entidades (átomos, moléculas, iones?) como el número de átomos existentes en 0,012 kg de carbono-12 puro. Esa cantidad enorme es el mol.
1 mol = 6,022 × 1023 átomos, moléculas o partículas
Siempre dependiendo de lo que estemos tratando. Si tratamos con moléculas serán moléculas, pero si tratamos con los átomos de esas moléculas serán átomos (pero multiplicados por su cantidad en ella). Por otro lado, pueden ser partículas si tratamos de establecer una relación con los protones o los electrones de un átomo.
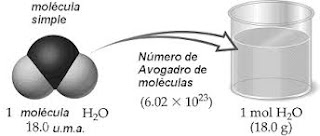
Como ejemplo, pongamos el agua: H2O. Dos átomos de hidrógeno y uno de oxígeno unidos de forma covalente y fuerte, reforzados con puentes de hidrógeno y en ángulo, 104,5 º. Bien, una molécula de agua tiene una masa molecular (Mr) de 18 uma (Unidades de Masa Atómica). Esto es que cada hidrógeno tiene 1 uma de masa, y hay dos hidrógenos, y el oxígeno tiene 16 uma de masa. La suma es sencilla: 1+1+16 = 18 uma. Bien, además podemos calcular la masa molar (la masa de un mol) dividiendo los gramos entre la masa molecular, y como buscamos un mol, resulta que la masa molecular de cualquier sustancia coincide en número con la masa molar de esa sustancia. Así que tenemos 18 g/mol para el agua. Esto es, un mol de agua tiene de masa 18 gramos.
Volviendo al mol y al ejemplo del agua. Siempre, podemos decir que un mol de agua son 6,022 × 1023 moléculas de agua, sin miedo a equivocarnos. Y que medio mol tiene 3,011 × 1023
moléculas de agua. O que, dos moles de agua contienen 12,044 × 1023 o lo que es igual 1,2044 × 1024 moléculas de agua. Hasta aquí bien. Pero en un mol que tiene esas moléculas existen más partes, están los átomos y también podemos referirnos a ellos. Y por tanto, podemos decir que en un mol de agua tenemos 1,2 × 1024 átomos de Hidrógeno y tenemos 6,022 × 1023 átomos de Oxígeno. Porque en una de esas moléculas hay 2 átomos de Hidrógeno y 1 de oxígeno.